Isotpe - Am Beispiel: Wasserstoff!
Beim Wasserstoff unterscheiden wir
- drei verschiedene Isotope!
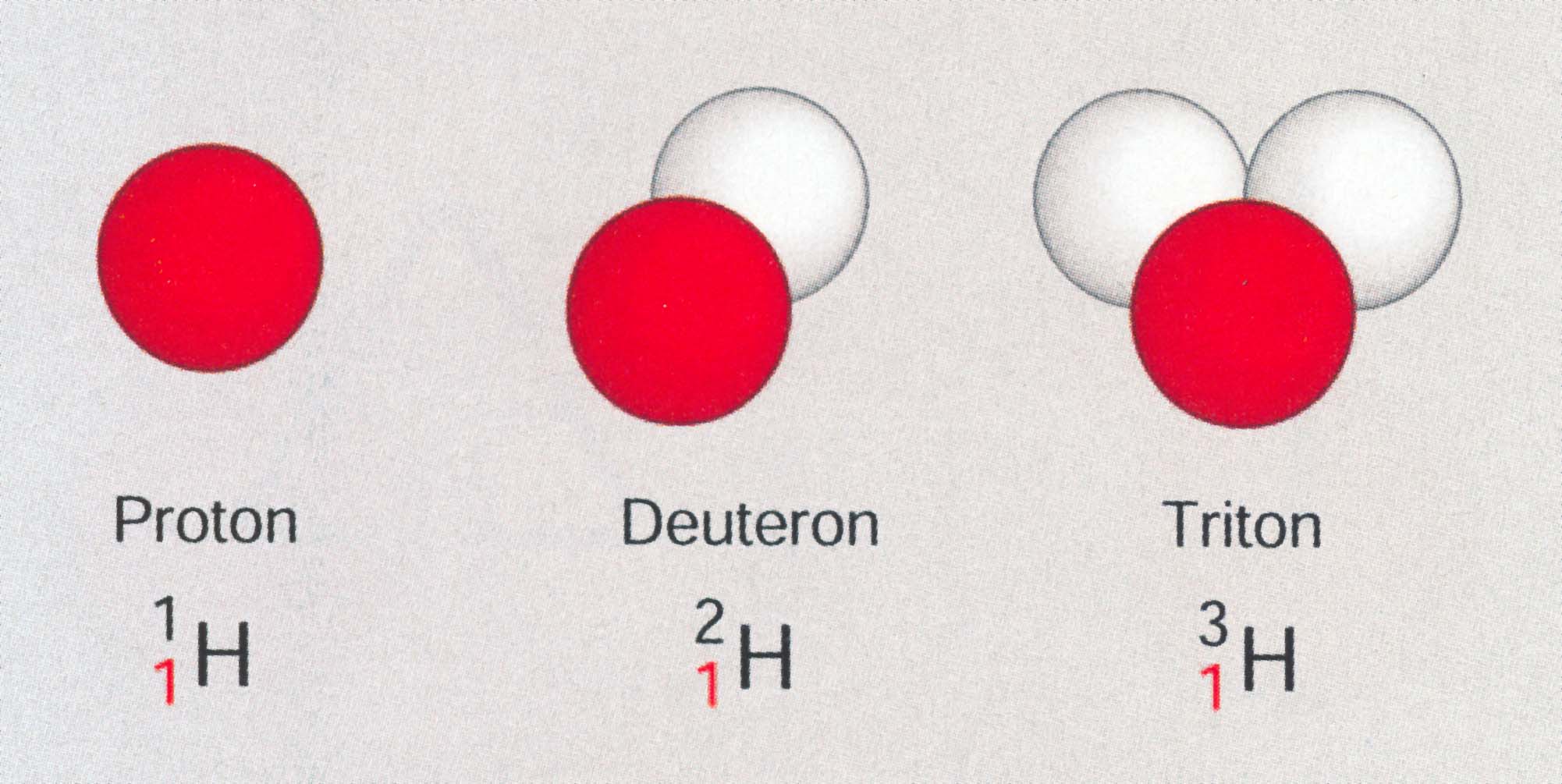
1. Den leichten Wasserstoff !
(Name: normaler Wasserstoff; Symbol: H; ; Vorkommen: 99,958%)
Er besitzt lediglich ein einziges Proton und kein Neutron im Atomkern.
Dieser Wasserstoff besitzt daher
- die Ordnungszahl 1 und
- die Massenzahl 1.
2. Den schweren Wasserstoff!
(Name: Deuterium; Symbol: D; Vorkommen: 0,015%).
Er besitzt ein Proton und ein Neutron im Atomkern.
Dieser Wasserstoff besitzt immer noch
- die Ordnungszahl 1(er hat ja nur ein Proton) hat aber
- die Massenzahl 2 (er besitzt ja ein zusätzliches Neutron)!
3. Den überschweren Wasserstoff!
(Name: Tritium; Symbol: T; Vorkommen: geringste Mengen).
Auch er besitzt nur ein Proton im Atomkern. Zusätzlich hat er aber
zwei Neutronen im Atomkern.
Auch dieser Wasserstoff besitzt immer noch die
- Ordnungszahl 1 (er hat immer noch nur ein Proton), aber er hat die
- Massenzahl 3
(zusätzlich zwei Neutronen)!
 |
[NW] [Biologie] [Physik] [Chemie] [Bio 10] [Ch 10] [Ph 7] [Ph 8] [Ph9] [Ph 10] [VA] [Kontakt]